수술 중 신경의 시각화를 위한 시분할 액정-편광 이미징 시스템 개발 및 타당성 검증
초록
얇거나 묻힌 신경은 육안으로 인식하기 어려워 수술 부작용이나 합병증으로 이어지는 사례가 많이 보고되고 있다. 따라서 본 논문에서는 수술 중 신경의 시각화가 가능하게 하는 간단한 구조의 액정-편광 이미징(LCPi, Liquid crystal-polarized light imaging) 시스템을 제안하고자 한다. 이 시스템은 시분할로 0도와 90도의 편광 영상을 획득하여 영상처리 후 편광 특성을 가진 영역을 확인할 수 있게 설계하였다. 시스템 성능을 확인하기 위해 백서의 좌골신경 주변부를 촬영한 후, 신경조직을 시각화하였다. 본 논문을 통해 LCPi 시스템의 가능성을 확인할 수 있었으며, 향후 최적화 과정을 통해 신경 손상을 최소화하기 위한 수술 중 신경 시각화 시스템으로서 활용될 것으로 전망된다.
Abstract
Since thin or buried nerves are difficult to recognize with the naked eye, many cases have been reported leading to surgical side effects or complications. Therefore, in this paper, we propose a liquid crystal-polarized light imaging(LCPi) system with a simple structure that allows visualization of nerves during surgery. The LCPi system is designed to acquire polarization images of 0 and 90 degrees by time division and to identify the region having polarization characteristics through image processing. The validation of the system was accomplished by imaging around the sciatic nerve of the rat and visualizing nerves against the surrounding tissue. The LCPi system is expected to be used as an intraoperative nerve visualization system to minimize nerve damage after the optimization process.
Keywords:
intraoperative nerve visualization system, intraoperative neurophysiologic monitoring, liquid crystal, polarizerⅠ. 서 론
의료 기술의 발전 및 정보의 축적과 더불어 신체의 피부를 절개하여 의학적 처리를 하는 수술이 활발하게 이루어지고 있으나, 수술 건수가 증가함에 따라 수술 부작용이나 합병증 발생에 대한 의료분쟁의 수 또한 증가하는 추세이다. 한국의료분쟁조정중재원이 발표한 “2018년도 의료분쟁 조정・중재 통계연보”[1]에 따르면 국내에서 발생한 의료분쟁 조정 건수는 2014년 이후 연 평균 11.5%의 증가추세를 보였으며, 2018년 조정 신청 건수는 2,926건으로 전년 대비 20.9% 증가한 것으로 나타났다.
신경 손상은 다리 또는 팔 근육의 약화 또는 마름, 통증, 감각장애, 배뇨장애, 성기능장애, 기립성 저혈압 또는 마비와 같은 심각한 병리학적 상태를 유발할 수 있으며, 손상된 신경의 경우 회복이나 재건이 매우 어렵다[2]-[5]. 특히 부교감 신경 섬유와 같이 가느다랗고 다른 조직에 파묻혀 존재하는 신경은 수술 중 인지가 어려워 과도한 견인, 열, 압력, 절단에 의해 쉽게 손상을 받을 수 있다. 따라서 수술 중 신경계의 자극과 손상을 감지하거나, 손상의 위험이 높은 신경의 위치를 쉽게 파악하여 궁극적으로 수술 부작용이나 합병증 발생을 최소화하고자 하는 수술 중 신경계 감시(Intraoperative neurophysiologic monitoring)에 대한 관심과 요구가 증대되고 있다.
임상에서 사용하고 있는 수술 중 신경계 감시 방법으로는 시각, 청각, 전정, 전기 자극으로 유발되는 뇌의 변화로 감각 신경계의 기능을 객관적으로 평가하는 시각유발전위검사(Visual evoked potential), 뇌간청각유발전위(Brainstem auditory evoked potential), 체성감각 유발전위(Somatosensory evoked potential), 운동유발전위(Motor evoked potential) 검사 방법과 직접 신경근을 자극하여 해당 근육의 전위를 측정하는 근전도검사(Electromyography)가 있다[6][7]. 이러한 방법들은 마취의 농도가 지나치게 높거나 체온과 혈압이 감소할 경우 근전도검사와 유발전위의 형성이 저해되고, 파형 크기 또한 감소되거나 없어질 수 있어 마취를 수행하는 의사와의 긴밀한 협력이 필요로 한다[7]-[9]. 하지만 얇거나 묻힌 신경은 다른 조직들과 육안으로 구별이 쉽지 않기 때문에 우발적인 신경의 견인, 열, 압력, 절단 등에 의한 신경손상이 여전히 발생할 수 있다[5].
이로 인해 신경의 시각화를 통해 수술 중 우발적인 신경손상을 줄이려는 연구가 활발히 이뤄지고 있는 추세이다. 이 중 가장 활발히 이뤄지고 있는 연구로는 형광 조영제를 이용한 기법으로 신경과 주변 조직과 뚜렷한 차이를 보여주었으나[5][10][11], 형광 조영제를 이용한 기법들은 잠재적인 위험성으로 인해 임상용으로 승인된 바 없다[11]-[13]. 이러한 문제점으로 인해 최근에는 형광 조영제 없이 신경을 둘러싼 외막의 편광 특성을 이용하여 말초신경을 시각화하는 광학 이미징 장치에 대한 연구도 이뤄지고 있다. 비록 형광 조영제에 비해 성능은 우수하지 않으나, 신경뿐만 아니라, 정맥 및 동맥의 식별까지 가능하다는 것을 보였다[14][15]. 이러한 결과로 말미암아 신경의 편광 특성을 이용하는 것이 수술 중 신경계 감시에 가장 적합하다 판단하였고, 본 논문에서는 인가되는 전압에 따라 빛의 위상을 변화시켜 보다 쉽고 빠르게 편광 각도를 제어할 수 있는 액정(Liquid crystal)을 이용하여 액정-편광 이미징 시스템(LCPi, Liquid Crystal-Polarized light imaging system)을 개발하였다.
Ⅱ. 관련 연구
2.1 형광 조영제를 이용한 신경 시각화
경의 시각화 연구는 주로 형광 조영제를 사용하여 신경을 추적하는 방법으로 이뤄지고 있다. Whitney[5]의 경우 마우스에서 형광 펩티드 NTQTLAKAPEHT(NP41)를 주사하여 모든 말초 신경이 2시간 내에 명확하게 묘사되는 것을 보여주었으며, Gibbs-Strauss[10]는 형광 조영제로 4,4’-[(2-methoxy-1,4-phenylene)di-(1E)-2,1-ethenediyl]bis-benzenamine(BMB)와 4-[(1E)-2-[4-[(1E)-2-[4-aminophenyl] ethenyl]-3-methoxyphenyl]ethenyl]-benzonitrile(GE3082)를 흰쥐와 돼지에 주사하여 신경과 다른 조직이 뚜렷하게 대비되는 것을 보여주었으나, 형광 조영제의 독성과 부작용 등 잠재적인 위험성으로 인해 현재까지 임상용으로 승인된 바 없을 뿐더러[11] 조영제 사용 준비시간, 비용, 용량 제약, 짧은 주기, 알레르기 반응 등 임상적용에 고려해야 되는 사항이 많다[12][13].
2.2 신경의 편광특성을 이용한 신경 시각화
신경조직은 미세소관이 신경축삭의 길이 방향에 따라 평행하게 배치되는 특성으로 인해 이방성 구조를 가지고 있으며[16], 이는 빛과 강한 이방성 상호작용을 초래하여 광 조사에 의해 선형 편광된 빛 반사를 유도한다고 알려져 있다[17]-[19]. Chin[15]은 편광판과 회전 가능한 디스크가 있는 장치로 구성된 CPLi(Collimated Polarized Light imaging) 현미경을 이용하여 인간 사체 조직의 손에 분포된 신경을 검출하였으며, Cha[14]는 1개의 광학 카메라, 1개의 편광 카메라, 2개의 근적외선 카메라, 총 4개의 카메라와 병렬 컴퓨팅 이미지 처리를 통해 돼지와 쥐 모델에서 신경뿐만 아니라, 정맥 및 동맥을 식별하는 기술을 선보였다. 하지만 Chin이 소개한 기술은 편광판과 신경축삭의 길이 방향을 평행하게 배치하는데 시간이 걸리고, 2개 이상의 카메라를 이용한 방식의 경우, 영상의 불일치를 보정하기 위해 각 영상 간 픽셀의 비교가 필요하게 되어 복잡한 영상처리 알고리즘이 필요하게 된다.
2.3 액정을 이용한 신경 시각화
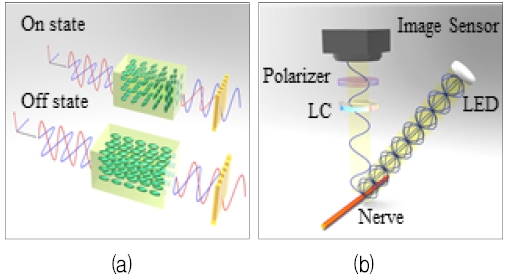
액정은 전압에 따라 액정의 정렬 방향이 변하는 특성을 갖고 있으며, 이 특성을 사용하면 간단한 전압 제어만으로 0도와 90도 위상의 빛을 선택적으로 투과시킬 수 있다[20][21]. 그림 1에서는 LCPi 시스템의 원리를 설명하고자 하였으며, 그림 1(a)는 액정에 인가되는 전압에 따른 빛의 위상 변화를, 그림 1(b)는 LED(Light Emitting Diode)에서 발광된 비편광성 빛이 신경조직에서 편광성 빛으로 반사된 후 액정, 편광판, 이미지 센서 순으로 들어가는 과정을 도식화한 것이다. 액정을 사용함으로써, 하나의 CMOS(Complementary Metal-Oxide Semiconductor) 카메라만을 통해 다양한 각도의 편광 이미지를 획득할 수 있으며, 기구설계뿐만 아니라, 영상처리 알고리즘도 단순하게 구현할 수 있다.
Ⅲ. 신경 시각화를 위한 시분할 LCPi 시스템
본 논문에서는 240Hz로 동작 가능한 액정(SSG-55150GB, 삼성, 대한민국)과 직교하는 편광판을 이용하여 간단한 구조의 편광 이미징 시스템을 개발하였다.
3.1 LCPi 시스템의 구성
시분할 LCPi 시스템의 구성은 크게 광학부과 영상처리 프로그램 두 부분으로 나누어져 있다. 광학부는 그림 2(a, b)와 같이 LED광원, 액정, 편광판, 제어보드(Control board)로 구성되며, 그림 2(c)와 같이 카메라(acA2500-60um, Basler)가 장착된 실체현미경(SMZ1270, Nikon)의 헤드에 장착 가능하다. 제어보드는 컴퓨터와 USB-to-RS232로 연결되어 제어신호를 주고받으며, LED 광원의 밝기 제어, 액정 전압 인가, 트리거 신호 발생의 역할을 한다. 트리거 신호는 액정에 전압을 인가하는 시간과 카메라 촬영 시간의 동기화를 위한 것으로 액정에 전압을 인가함과 동시에 펄스 신호로 발생되어 카메라의 입력으로 연결된다.
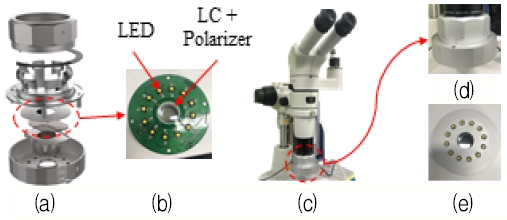
LCPi system for nerve visualization. (a) Exploded view of the optical part, (b) Control board for LED illumination, liquid crystal control and triggering, (c) Optical part of LCPi system mounted on microscope, (d) Enlarged image of the optical part, (e) Bottom-view of the optical part
0도와 90도의 위상차를 갖는 영상을 시분할로 연속하여 카메라로 촬영하고, 이 영상은 컴퓨터와 USB3.0 규격으로 연결되어 초당 60 프레임으로 저장된다.
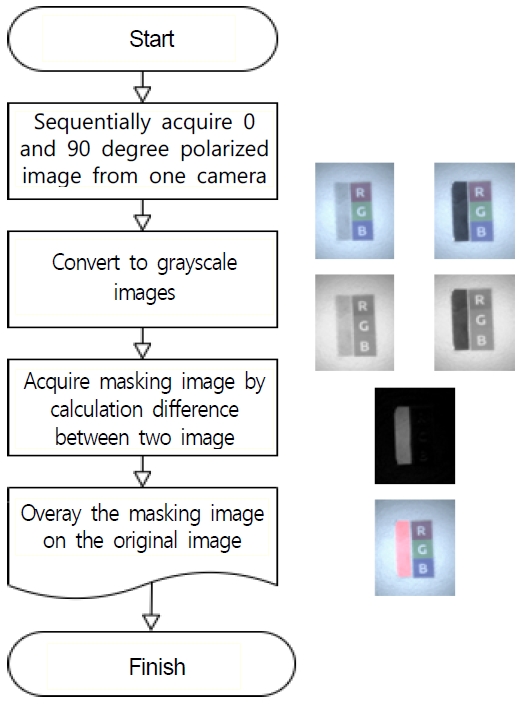
카메라로부터 획득한 컬러 영상은 회색조로 변환된 후 트리거 신호에 따라 얻어진 프레임 간의 차를 구한다. 그 후, 정해진 임계 값에 따라 영상을 이진화해 편광 영역에 대한 마스킹 영상을 구한다.
마스킹 영상은 원본 이미지 위에 겹쳐 보여진다. 그림 3에서는 획득된 영상에서 편광성을 보이는 영역을 검출하는 알고리즘을 도식화하였다. 그림 3의 우측 영상 1열은 편광성 물체에서 반사된 빛이 특정 방향의 빛을 주된 성분으로 갖는 특성을 보여준다. 예를 들어 물체에서 세로로 편광된 빛이 반사되었다고 가정하면, 가로 편광필터를 통과할 때는 빛의 크기가 작아지고, 세로 편광필터를 통과할 때는 빛의 크기가 유지된다. LCPi 시스템으로 촬영한 두 영상에서 밝기 부분의 변화만을 검출하기 위해 그레이 영상(2열)으로 변환한 뒤, 픽셀값의 차이를 이용하면 3열의 영상처럼 편광성 물체만을 분할할 수 있다.
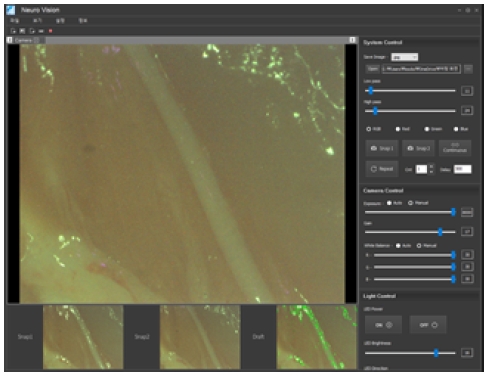
영상처리 프로그램(Neuro vision)은 객체지향 언어인 C++로 개발되었으며, 사용자 인터페이스 구성은 그림 4와 같이 영상 표시부, 시스템 제어부, 카메라 제어부, LED 제어부로 되어 있다. 영상 표시부는 실시간 영상, 0도 방향의 정지영상(Snap 1), 90도 방향의 정지영상(Snap 2), 신경이 시각화된 결과영상(Draft)으로 구성되어 있다. 시스템 제어부는 차단주파수 값을 조절할 수 있는 저역통과 필터, 고역통과 필터, RGB 채널 별 영상 추출기능과 단계별 촬영 기능을 가지고 있다. 카메라 제어부는 노출, 화이트 밸런스, 이득 조절 기능을 가지고 있으며, LED 제어부는 조명 전원 및 밝기 조절기능을 가지고 있다.
3.2 in vivo 실험
본 논문에서는 암컷 Sprague-Dawley계 흰쥐(약 270g)를 실험동물로 사용하였으며, 습도 55±5%, 온도 22±1℃, 12시간 간격으로 명암주기로 제어된 시설에서 표준사료와 물을 충분히 공급하면서 환경에 적응시켰다. 실험동물의 마취는 졸레틸(Zoletil)과 럼푼(Rompun)을 3:1로 혼합하여 근육 내 주사하여 마취시키고, 관류 없이 과잉 마취함으로써 희생시켰다. 실험동물 관리 및 처치와 관련된 모든 절차는 Woojung BSC, Inc. 동물실험윤리 위원회(승인 번호: WJIACUC 20130212-1-07)의 지침을 준수하여 수행하였다.
수술은 먼저 백서의 사지를 고정한 뒤 좌측 둔부와 대퇴부 후면을 면도기로 삭모하고 베타딘과 알콜로 소독한다. 삭모 된 피부의 약 3cm를 종 절개하고 외전 근(Abductor muscles)을 횡 방향으로 박리하여 둔근(Gluteus muscle)과 대퇴 이두근(Biceps femoris) 사이의 좌골 신경을 노출한다. 이후 백서를 LCPi 시스템이 장착된 실체현미경의 재물대 위에 위치하여 신경 시각화를 위한 장치로서의 타당성을 검증하였다.
Ⅳ. 실험 및 결과 분석
본 논문에서는 액정에 인가되는 전압에 따라 액정 분자의 배열이 달라지게 되는 원리를 이용하여 0도와 90도의 편광성의 이미지를 빠르게 획득할 수 있으면서도 구조도 단순한 편광 이미징 시스템을 개발하고자 하였으며, 해당 장비는 실험동물을 통해 신경 시각화 장비로서의 사용가능성을 검증하고자 하였다.
4.1 편광필름을 이용한 기기 성능 검증
실험동물을 통한 실험에 앞서, LCPi 시스템의 편광 검출 능력은 삼각형 모양의 편광필름을 실체현미경에 장착된 LCPi의 광학부로 촬영한 후 NeuroVision을 통해 검증하였다. 그림 5에서 볼 수 있듯, NeuroVision의 정지영상1과 정지영상2의 이미지 비교에서는 액정의 전압 인가 여부에 따라 편광필름 영역의 밝기 차이가 극명하게 나타나는 것을 확인할 수 있었으며, 결과영상에서는 편광필름 영역만이 올바르게 형광으로 표시되는 것을 확인할 수 있었다.
4.2 광원의 파장에 따른 성능 검증
Bueno[22]는 광원의 파장에 따라 편광 검출 성능이 차이가 난다고 발표한 바 있다. 본 연구에서는 신경 검출에 최적화된 파장을 선정하기 위해 실험동물의 좌골신경에 해당되는 조직부위가 보이도록 편광판과 카메라를 설치한 후 400, 450, 500, 550, 600, 650nm의 파장을 순차적으로 조사하여 신경조직의 편광차이를 확인하였다.
그림 6에서 볼 수 있듯, 400nm와 650nm 파장의 경우 정지영상 간 편광차이가 거의 없으며, 500, 550, 600nm 파장의 경우 편광차이는 있으나, 신경조직과 주변조직 간 영역의 구분은 명확하지 않았다. 450nm 파장의 경우 신경조직의 편광차이가 뚜렷하여 주변조직과의 구분이 명확하였다.
4.3 백서의 좌골신경 촬영을 통한 성능 검증
LCPi 시스템의 신경검출 성능을 입증하기 위해 실험동물의 좌골신경에 해당되는 조직부위를 실제 촬영하여 영상화하였다. 그림 7에서 볼 수 있듯 LCPi 시스템을 통해 동일한 위치로 0도 방향의 위상 빛의 영상, 90도 방향의 위상 빛의 영상, 그리고 영상처리된 영상 획득이 가능하였으며, 영상처리 알고리즘을 통한 신경의 시각화 또한 가능한 것으로 판단되었다.
Ⅴ. 결론 및 향후 과제
실제 의료행위에서 신경을 검출하기 위해 사용되는 방법들은 고가의 장비를 사용해야 될 뿐만 아니라, 신경조직을 확인하기 위해 상당한 시간과 노력이 필요로 한다. 본 논문에서는 이러한 문제를 해결하기 위해 신경조직에서 편광성 빛으로 반사되는 특성과 액정에 인가되는 전압에 따라 액정을 통과하는 빛의 위상이 회전하는 원리를 이용함으로써 간단한 구조의 신경 시각화 시스템인 LCPi 시스템을 선보였다. LCPi 시스템은 광학 장치와 영상처리 알고리즘만을 사용하기 때문에 몇몇 선행 연구에서 선보인 형광 펩타이드나 조영제 주입에 따른 부작용 및 유해성 문제로 부터 안전하다는 장점도 가지고 있다[14][15].
편광각에 따른 신경의 밝기 변화를 이용한 시스템이 Chin과 Cha에 의해 발표된 바 있으나, Chin이 제안한 시스템의 경우 수동으로 편광 각도를 조정하여야 하므로 번거롭고 시간이 오래 걸리는 단점이 있으며[14], Cha가 제안한 시스템은 네 개의 카메라를 이용하여 복잡한 렌즈 설계가 필요하고 여러 영상을 빠른 시간 내에 처리해야 하므로 컴퓨팅 리소스가 상당히 필요하다는 단점이 있다[15]. 반면, 본 논문에서 개발한 LCPi 시스템은 단 하나의 카메라로 0도와 90도의 위상차를 갖는 영상을 시분할로 획득할 수 있어 보다 간단한 구조를 가질 뿐만 아니라, 가벼운 영상처리 알고리즘만으로도 신경시각화가 가능하다는 장점이 있다. 기존 시스템의 주요 구성과 LCPi 시스템의 구성을 표 1에 비교하였다.
이러한 장점에도 불구하고 LCPi 시스템은 두가지 한계를 가지고 있다. 첫째, 주변의 반사광에 따른 일부 조직에서 과노출 노이즈가 발생하는 문제가 있다. 해당 문제는 편광을 이용하여 신경 검출을 하고자한 이전 연구들에서도 관찰되었으며, 특히 지방 조직은 파동이 치는 듯한 표면 구조로 인해 상이한 산란 특성을 일으켜 노이즈가 발생한다고 언급한 바 있다[14][15][23]. 이를 제거하기 위해 저역필터와 광원 앞에 빛 산란막을 부착하여 조직에 균일하게 조사하도록 해보았으나, 그림 7(c)에서 볼 수 있듯 영상에서 노이즈가 여전히 존재하였다. 또다른 한계로는 신경의 정렬방향과 편광판의 편광방향의 불일치성이다. 신경의 시각화를 위해서는 신경의 정렬방향과 편광판의 편광방향이 일치하는 최적의 위치를 찾아야 한다. 하지만 신경은 다양한 위치에서 다양한 각도로 분포하기 때문에 광학부를 회전하며 최적의 위치를 찾아야 하는 불편함이 있다. 이러한 두 가지 한계는 광학부 내 액정을 대신하여 위상지연판(Retarder)을 사용하면 해결 가능할 것으로 예상된다. 위상 지연판은 0도와 90도로 회전하는 액정과 달리 0도부터 180도까지 회전 가능한 특성을 갖고 있기 때문에 다양한 각도에서 조직 촬영이 가능하다. 이렇게 획득한 영상을 본 논문에서 사용된 알고리즘에 적용한다면 상이한 산란 특성을 일으키는 조직과 신경을 보다 뚜렷하게 구별할 수 있을 것으로 예상된다. 이와 더불어 딥 러닝 알고리즘을 이용한다면 성능 향상에 큰 도움을 줄 수 있을 것으로 보인다.
본 논문에서는 정량적 분석을 수행하지는 않았지만 실험동물을 통해 LCPi 시스템의 신경 검출 장치로서 사용 가능성을 보여준 것으로 판단되며, 향후 본 기술은 신경의 손상을 최소화할 수 있는 기능을 갖춘 특수 복강경이나, 내시경 또는 영상 유도 수술시스템 같은 의료시장을 비롯하여 다양한 신경연구 분야에 활용될 수 있을 것으로 전망된다.
Acknowledgments
본 연구는 산업통상자원부 및 산업기술평가관리원(KEIT) 연구비 지원에 의한 연구임 (10052089)
References
- "Korea Medical Dispute Mediation and Arbitration Agency", Medical dispute mediation and arbitration statistical yearbook 2018, pp. 34, Apr. 2019.
-
P. D. Choi, C. B. Novak, S. E. Mackinnon, and D. G. Kline, "Quality of life and functional outcome following brachial plexus injury", Journal Hand Surgery, Vol. 22, No. 4, pp. 605-612, Jul. 1997.
[https://doi.org/10.1016/S0363-5023(97)80116-5]

-
S. E. Coulson, J. O'Dwyer N, R. D. Adams, and G. R. Croxson, "Expression of emotion and quality of life after facial nerve paralysis", Otology & Neurotology, Vol. 25, No. 6, pp. 1014-1019, Nov. 2004.
[https://doi.org/10.1097/00129492-200411000-00026]

-
G. C. Langhout, and K. F. D. Kuhlmann, et al., "Nerve detection during surgery optical spectroscopy for peripheral nerve localization", Lasers Medical Science, Vol. 33, No. 3, pp. 619-625, Apr. 2018.
[https://doi.org/10.1007/s10103-017-2433-1]

-
M. A. Whitney and J. L. Crisp, et al., "Fluorescent peptides highlight peripheral nerves during surgery in mice", Nature Biotechnology, Vol. 29, No. 4, pp. 352-356, Apr. 2011.
[https://doi.org/10.1038/nbt.1764]

-
J. R. Daube, "Intraoperative monitoring reduces complications and is therefore useful", Muscle Nerve, Vol. 22, No. 8, pp. 1151-1153, Aug. 1999.
[https://doi.org/10.1002/(SICI)1097-4598(199908)22:8<1151::AID-MUS24>3.0.CO;2-T]

- D. W. Seo, "Intraoperative neuromonitoring", Ann Clin Neurophysiol, Vol. 10, No. 1, pp. 1-12, Jun. 2008.
- E. Kochs, R. D. Treede and J. Schulte am Esch, "Increase in somatosensory evoked potentials during anesthesia induction with etomidate", Anaesthesist, Vol. 35, No. 6, pp. 359-364, Jun. 1986.
-
S. M. Kim, S. H. Kim, D. W. Seo, and K. W. Lee, "Intraoperative neurophysiologic monitoring: basic principles and recent update", Journal of Korean Medical Science, Vol. 28, No. 9, pp. 1261-1269, Sep. 2013.
[https://doi.org/10.3346/jkms.2013.28.9.1261]

-
S. L. Gibbs-Strauss and K. A. Nasr, et al., "Nerve-highlighting fluorescent contrast agents for image-guided surgery", Mol Imaging, Vol. 10, No. 2, pp. 91-101, Apr. 2011.
[https://doi.org/10.2310/7290.2010.00026]

-
N. Kosaka, M. Ogawa, P. L. Choyke, and H. Kobayashi, "Clinical implications of near-infrared fluorescence imaging in cancer", Future Oncol, Vol. 5, No. 9, pp. 1501-1511, Nov. 2009.
[https://doi.org/10.2217/fon.09.109]

-
J. T. Alander and I. Kaartinen, et al., "A review of indocyanine green fluorescent imaging in surgery", International Journal of Biomedical Imaging, Vol. 2012, Article ID 940585, pp. 1-26, Apr. 2012.
[https://doi.org/10.1155/2012/940585]

-
A. Matsui and E. Tanaka, et al., "Real-time intra-operative near-infrared fluorescence identification of the extrahepatic bile ducts using clinically available contrast agents", Surgery, Vol. 148, No. 1, pp. 87-95, Jul. 2010.
[https://doi.org/10.1016/j.surg.2009.12.004]

-
J. Cha and A. Broch, et al., "Real-time, label-free, intraoperative visualization of peripheral nerves and micro-vasculatures using multimodal optical imaging techniques", Biomedical Optics Express, Vol. 9, No. 3, pp. 1097-1110, Mar. 2018.
[https://doi.org/10.1364/BOE.9.001097]

-
K. Chin and A. F. Engelsman, et al., "Evaluation of collimated polarized light imaging for real-time intraoperative selective nerve identification in the human hand", Biomedical Optics Express, Vol. 8, No. 9, pp. 4122-4134, Sep. 2017.
[https://doi.org/10.1364/BOE.8.004122]

-
R. Oldenbourg, E. D. Salmon, and P. T. Tran, "Birefringence of single and bundled microtubules", Biophysical Journal, Vol. 74, No. 1, pp. 645-654, Jan. 1998.
[https://doi.org/10.1016/S0006-3495(98)77824-5]

-
V. Backman and R. Gurjar, et al., "Polarized light scattering spectroscopy for quantitative measurement of epithelial cellular structures in situ", IEEE Journal of Selected Topics in Quantum Electronics, Vol. 5, No. 4, pp. 1019-1026, Aug. 1999.
[https://doi.org/10.1109/2944.796325]

-
L. B. Cohen, R. D. Keynes, and B. Hille, "Light scattering and birefringence changes during nerve activity", Nature, Vol. 218, No. 5140, pp. 438-441, May. 1968.
[https://doi.org/10.1038/218438a0]

-
X. C. Yao and A. Foust, et al., "Cross-polarized reflected light measurement of fast optical responses associated with neural activation", Biophys J, Vol. 88, No. 6, pp. 4170-4177, Jun. 2005.
[https://doi.org/10.1529/biophysj.104.052506]

- C. Park and W. Lee, "Development of Dual Polarization Laser Radar System for 24 hours Continuous Monitoring of Aerosols, Asian-dust and Cloud", The Journal of Korean Institute of Information Technology, Vol. 9, No. 12, pp. 1-6, Dec. 2011.
-
T. Tomomi, M. Shribak, and R. Oldenbourg. "Living cells and dynamic molecules observed with the polarized light microscope: the legacy of Shinya Inoue", The Biological Bulletin, Vol. 231, No. 1, pp. 85-95, Aug. 2016.
[https://doi.org/10.1086/689593]

-
J. M. Bueno and G. M. Perez, "Combined effect of wavelength and polarization in double-pass retinal images in the human eye", Vision Res, Vol. 50, No. 23, pp. 2439-2444, Nov. 2010.
[https://doi.org/10.1016/j.visres.2010.09.005]

-
J. Qi, M. Ye, M. Singh, N. T. Clancy, and D. S. Elson, "Narrow band 3×3 Mueller polarimetric endoscopy", Biomedical Optics Express, Vol. 4, No. 11, pp. 2433-2449, Oct. 2013.
[https://doi.org/10.1364/BOE.4.002433]


2011년 2월 : 서울대학교 전기전자 컴퓨터(공학사)
2017년 9월 : 서울대학교 전기전자 컴퓨터(공학박사)
2019년 9월 ~ 현재 : 테크노와이시스템 연구팀장
관심분야 : 신경신호분석, 의료 영상 딥러닝

2009년 8월 : 울산대학교 기계자동차공학부(공학사)
2014년 8월 : 한림대학교 의학과(의과학박사)
2017년 11월 ~ 현재 : 서울대학교 치과병원 연구교수
관심분야 : 전기신경생리학, 신호분석, 의료기기

1999년 2월 : 서울대학교 물리교육과(이학사)
2011년 2월 : 서울대학교 물리학부(이학박사)
2017년 12월 ~ 현재 : 한국산업기술시험원 의료기기연구센터 센터장
관심분야 : 의료기기

2009년 8월 : 서울대학교 전기전자 컴퓨터(공학사)
2016년 2월 : 서울대학교 전기전자 컴퓨터(공학박사)
2019년 9월 ~ 현재 : 경기과학기술대학교 조교수
관심분야 : 의료기기, 딥러닝